
①催化效率,Cat2(填“>”、“<”或“=”)Catl。
②a点(填 “达到”或 “未达到”)平衡,理由是。b点之后CO2的转化率降低,可能的原因是。

①p2 (填 “>”、 “<”或 “=”)p1 , 随着温度升高,不同压强下,CO2的平衡转化率接近相等,其主要原因是。
②已知M点对应的容器体积为1 L,则在300℃下平衡常数K=(只列计算式)。
已知:
则;若将两等份
和
分别充入恒压密闭容器中,在无催化剂和有催化的情况进行反应,相同时间下测得
的转化率与温度的关系如图所示,M点时
转化率相等的主要原因是。


①表示的体积分数随温度变化的曲线是 (填数字序号)。
②A、B、C三点对应的化学平衡常数、
、
从大到小的顺序为。
③205℃时,反应达到平衡后,的平衡转化率为 (结果保留一位小数),若平衡时总压为P,平衡常数
(列出计算式。以分压表示,分压=总压×物质的量分数)。

总反应: CO(g) + N2O(g) CO2(g) + N2(g) ∆H= kJ·mol-1; 该总反应的决速步是反应 (填 “①"或“②”),该判断的理由是.
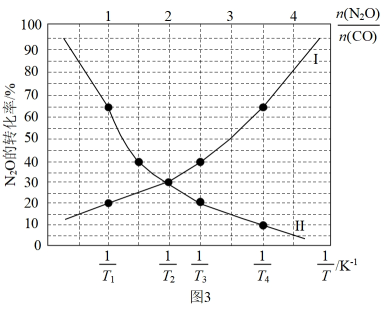
①表示N2O的转化率随的变化曲线为曲线(填“I”或“II”);
②T1T2 (填“>”或“<"),该判断的理由是
③已知:该反应的标准平衡常数 , 其中
为标准压强 (100kPa),p(CO2)、p(N2)、 p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数
= ( 计算结果保留两位有效数字,p分=p总 ×物质的量分数)。
已知:CO2氧化C2H6制C2H4的主反应热化学方程式为:C2H6(g) + CO2(g)=C2H4(g) + CO(g) + H2O(g) ΔH=+177kJ·mol-1
I. C2H6(g)=C2H4(g) + H2(g) (快) ΔH1
II. CO2(g) + H2(g)= CO(g) + H2O(g) (慢) ΔH2=+42kJ·mol-1
则:①反应I的ΔH1 = kJ ·mol-1。
②已知:ΔG=ΔH- T·ΔS。当ΔG>0,反应非自发;当ΔG<0,反应自发。若反应I的ΔS=+120J·K-1·mol-1 , 反应I自发进行的最低温度T=K。
③相比于提高c(C2H6) ,提高c(CO2)对主反应总速率影响更大,其原因是。
①CH3- CH3→CH3- CH2·+ H++e- ,
②CH3-CH2·→CH2=CH2+H++e- ,
③CO2+e-→ ,
④+ H+→·COOH,
⑤ ,
则:自由基CH3-CH2·的电子式为 ,⑤的反应式为。
①其他条件相同时,1mol C2H6与1mol CO2经相同反应时间测得如表实验数据:
|
实验 |
温度/K |
催化剂 |
C2H4的产率% |
|
实验1 |
400 |
催化剂1 |
55.0 |
|
400 |
催化剂2 |
62.3 |
|
|
实验2 |
500 |
催化剂1 |
68.5 |
|
500 |
催化剂2 |
80.1 |
在催化剂相同时,温度越高C2H4产率更高的原因是 ; 相同温度时,催化剂2催化下C2H4产率更高的原因是。
②在容器体积为1.0L,充入2 mol C2H6和3 mol CO2同时发生主、副反应,乙烷的平衡转化率、乙烯的选择性与温度、压强的关系如图所示。则:判断P1>P2的理由是 ;M点主反应的平衡常数为(结果保留2 位有效数字)。

i:CO (g) + 2H2(g)⇌CH3OH (g) ΔH1=- 90. 1KJ/ mol
ii:2CH3OH (g)⇌CH3OCH3(g)+ H2O(g) ΔH2=- 24.5KJ/mol
则总反应的ΔH= ; 若反应过程中能量变化如图所示,则总反应速率主要由反应 (选填“i ”或“ii”)决定。

a.升高温度 b.增大压强 c.使用合适催化剂 d.及时分离二甲醚

①反应在100℃,5. 0 ×105Pa时,CO的平衡转化率α= ,判断依据是 ,该条件下的平衡体系中二甲醚的体积分数约为 %(保 留小数点后一位)。
②一定温度下,同一反应用平衡浓度表示的平衡常数Kc和用平衡分压表示的平衡常数Kp间存在定量关系,可以借助公式pV= nRT进行推导(其中T为体系温度;p为气体压强;V为气体体积;n为气体物质的量;R为常数)。则当体系温度为T时,总反应Kc与Kp的关系为Kc=Kp(用含 R、T的式子表示)。
①2H2(g)+O2(g)= 2H2O(g) ΔH1= -484 kJ· mol-1
②COS(g)+ H2O(g)⇌H2S(g)+CO2(g) ΔH2= -36kJ·mol-1
③CO的燃烧热为283 kJ·mol-1
反应CO(g)+ H2S(g)⇌COS(g)+ H2(g)的 ΔH= kJ·mol-1。
+
关于该反应的下列叙述正确的是(填标号)。
A.步骤①是慢反应,活化能较大
B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物
D.更换催化剂可改变E和ΔH
+
300℃和320℃时,φ(H2S)随时间变化关系的曲线分别是、,判断的理由是。
反应Ⅰ:CO2(g)+H2(g)H2O(g)+CO(g) △H1
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) △H2=-90.0kJ·mol-1
反应Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
反应Ⅳ:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H4=-165.0kJ·mol-1
反应Ⅴ:2CO2g)+6H2(g)C2H4(g)+4H2O(g) △H5=-122.7kJ·mol-1
回答下列问题:
温度/K CO2转化率 | 500 | 600 | 700 | 800 |
1 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 40 | 22 |
①下列说法中正确的是(填英文字母)。
A.增大氢碳比,平衡正向移动,平衡常数增大
B.v(CH3OH)=v(CO2)时,反应达到平衡
C.当混合气体平均摩尔质量不变时,达到平衡
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,某时刻测得容器内CO2、H2、CH3OH、H2O的物质的量分别为2mol、2mol、1mol和1mol,则此时正反应速率和逆反应速率的关系是(填英文字母)。
A.v(正)>v(逆) B.v(正)<v(逆) C.(正)=r(逆) D.无法判断

①该催化剂在较低温度时主要选择反应(“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究发现,若温度过高,三种含碳产物的物质的量会迅速降低,其主要原因可能是:。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。则该温度下反应Ⅲ的平衡常数K(Ⅲ)=L2/mol2(保留两位小数)。


①反应开始后的16小时内,在第种催化剂作用下,收集的CH4较多。
②0~20小时(h)内,在第Ⅰ种催化剂作用下,O2的平均生成速率v(O2)=。实验测得当温度高于560℃,O2的平均生成速率明显下降,原因可能是。
已知:a. C(s) + 2H2(g) ⇌CH4(g) ΔH1
b. 2H2(g) + O2(g) = 2H2O(g) ΔH2
c. 2C(s) + O2(g) = 2CO(g) ΔH3
①反应CH4(g)+H2O(g)⇌ CO(g)+3H2(g)的ΔH= 。
②下列说法中,无法说明该反应达到平衡状态的是(填字母)。
a.CH4体积分数不再变化 b.气体的压强不再变化
c.体系的密度保持不变 d.消耗1 mol CH4同时消耗3 mol H2
③一定温度时,在体积为2 L的恒容密闭容器中,充入0.25 mol的CH4和0.25 mol的水蒸气发生以上反应。测得CH4平衡时的转化率与温度、压强的关系如图2所示,则p1 p2 (填“>”“<”或“=”);温度为1100 ℃时,y点的浓度平衡常数K=。

乙烷氧气氧化裂解制乙烯,除发生反应②外,还发生副反应③: , 在800℃时用乙烷氧气氧化裂解制乙烯,乙烷的转化率、乙烯的选择性和收率随投料比
的变化关系如图所示。

已知:
的选择性
的收率=
的转化率×
的选择性
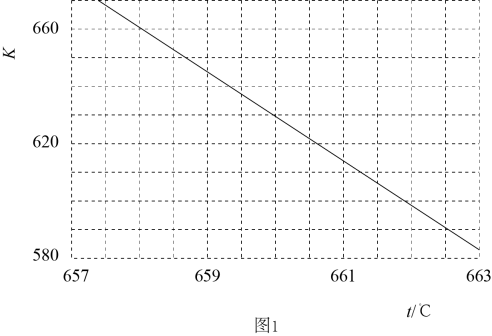
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
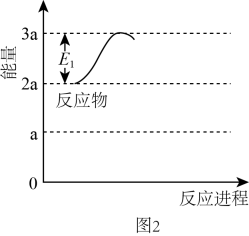
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
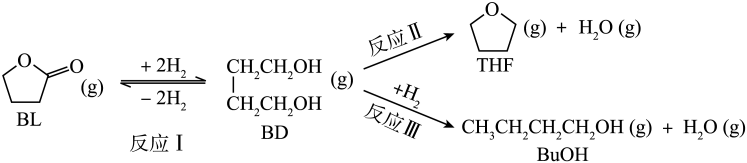
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故
压强近似等于总压。回答下列问题:

几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
|
物质 |
|
|
|
|
|
能量 |
0 |
-394 |
52 |
-242 |
则。

①(填“>”“<”或“=”,下同)
, 平衡常数
。
②TK时,某密闭容器中发生。上述反应,反应进行到不同时间测得各物质的浓度如下表:
|
时间浓度/mol/L 物质 |
0 |
10 |
20 |
30 |
40 |
50 |
|
|
6.00 |
5.40 |
5.10 |
9.00 |
8.40 |
8.40 |
|
|
2.00 |
1.80 |
1.70 |
3.00 |
2.80 |
2.80 |
|
|
0 |
0.10 |
0.15 |
3.20 |
3.30 |
3.30 |
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是(填字母)。
A.通入一定量 B.通入一定量
C.加入合适的催化剂 D.缩小容器容积
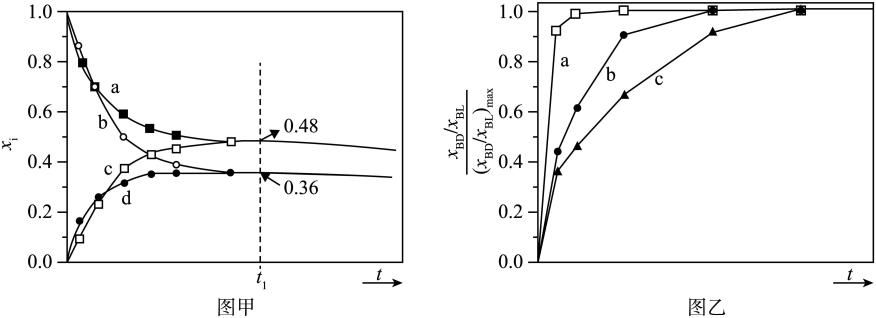
Ⅰ.
Ⅱ.
图丙是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是____(填字母)。

②上述反应分两步进行:
第一步(写化学方程式)△H> 0
第二步Cu/Zn* + 2H2 + CO2 = Cu/ZnO* + CH3OH △H< 0
③第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为。
a.  b.
b. 
c.  d.
d. 
主反应CO2(g) +3H2(g) CH3OH(g)+H2O(g) △H<0
副反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H>0
一定条件下,在装有催化剂的密闭容器中投入amolCO2和3amolH2 , 发生上述合成反应。
①在相同时间内,测得甲醇产率与温度的关系如图所示。温度为470K时,图中P点(填“处于”或“不处于”)平衡状态;490K之后,甲醇的产率随温度的升高而减小的原因可能是。

②某温度下,达平衡时容器中CH3OH的物质的量为c mol, CO的物质的量为d mol。则此条件下CO2的转化率为(列式表示,下同);甲醇的选择性(指转化为甲醇的CO2占发生反应的CO2的百分比)为;此条件下副反应的平衡常数为。

① 正、逆反应的活化能分别为m kJ/mol、n kJ/mol;
② 正、逆反应的活化能分别为p kJ/mol、q kJ/mol。
用NH3处理汽车尾气中的NO的反应为: , 该反应的△H=。
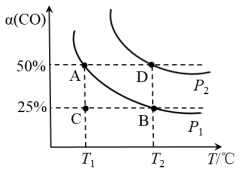
Ⅰ. Ⅱ.
Ⅲ.
Ⅳ. Ⅴ.
Ⅵ.
经测定汽车尾气中生成物及反应物浓度随温度变化关系如图1和图2所示:
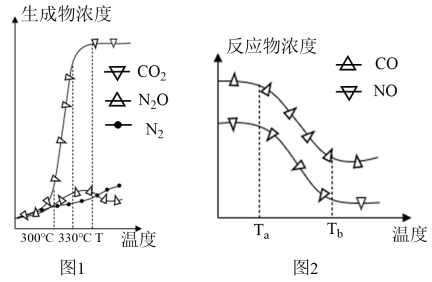
①图1中,温度为330℃时反应V的活化能反应VI的活化能(填“<”、“>”或“=”),反应VI的焓变△H0(“<”或“>”)。
②图2中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是。



①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
|
时间/min |
0 |
60 |
120 |
180 |
240 |
300 |
360 |
|
压强/kPa |
80 |
74.2 |
69.2 |
65.2 |
61.6 |
58 |
58 |
该温度下,若平衡时HCl的体积分数为10%。此时CH2=CHCH3的转化率为。反应①的压力平衡常数Kp=kPa-1(保留小数点后2位)。

保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是____。


;
。
则 (g)
(g)
 (g)+H2(g)
(g)+H2(g) 。试推断该反应在下可自发进行(填“高温”、“低温”或“任何温度”)。
 (g)
(g) (g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是____。
(g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是____。

 )的平衡转化率与水蒸气的用量、体系压强的关系图。
)的平衡转化率与水蒸气的用量、体系压强的关系图。
①图中压强100kPa(填“>”、“<”或“=”)。在压强
下,c点转化率高于a的原因是。
②若b点平衡转化率为50%,则该温度下,苯乙烯制备反应的分压平衡常数kPa(分压=总压×物质的量分数)。
①已知H2的燃烧热△H1=- 285. 8 kJ·mol-1 , CH4的燃烧热△H2=- 890.3 kJ·mol-1 , H2O(g)=H2O(l)△H3=-44 kJ·mol-1 , 则上述反应的△H= kJ·mol-1。
②相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/mol·L-1 | c(H2)/ mol·L-1 | c(CH4)/ mol·L-1 | c(H2O)/ mol·L-1 | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为。
I. CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H=-49.5 kJ·mol-1
II. CO(g) +2H2 (g) CH3OH(g) △H=-90.4 kJ·mol-1
III. CO2(g)+ H2(g) CO(g)+ H2O(g) △H=+40.9 kJ·mol-1
①为同时提高CO2的平衡转化率和CH3OH的平衡产率,除降低温度外,还可采取的措施是(写一条)。
②设 为相对压力平衡常数,是用相对分压(气体分压除以100kPa)代替浓度计算的平衡常数。如图为反应(填“II”或“III”)的lg
随示
(n>m)的变化关系。在图中n点对应温度下、原料组成为n(CO2): n(H2)=1:3、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为9kPa,H2的平衡转化率为。


物质 | NO(g) | H2(g) | H2O(g) | N2(g) |
标准生成热(kJ·mol-1) | 90.25 | 0 | -241.8 | 0 |
①ΔH=kJ·mol-1 , 已知该反应能自发进行,则所需条件为(高温、低温、任意温度)。
②一定体积密闭容器中,既能加快反应速率又能提高NO平衡转化率的方法是。
③某温度下,等物质的量的NO和H2在恒容密闭容器中发生反应,起始压强为100 kPa。
达平衡时,总压减少20%,NO的转化率为,该反应的平衡常数Kp=。
Ⅰ.2NO(g)→N2O2(g) ΔH1
Ⅱ.N2O2(g)+O2(g)→2NO2(g) ΔH2 , 其反应过程能量变化示意图如图1。

①决定NO氧化反应速率的步骤是(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图2。转化相同量的NO,在温度(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图1)分析其原因:。

(a)CH3COOCH3(g)+2H2(g)C2H5OH(g)+CH3OH(g) △H=-23.6kJ·mol-1
(b)2CH3COOCH3(g)+2H2(g)CH3COOC2H5(g)+2CH3OH(g) △H=-22.6kJ·mol-1
(c)CH3COOCH3(g)+H2(g)CH3CHO(g)+CH3OH(g) △H=+44.2kJ·mol-1
上述三个反应中随着温度升高反应的平衡常数会逐渐增大(填a、b或c)。

①若n起始n起始(CH3COOCH3)=1mol,则500K下反应达到平衡时生成C2H5OH的物质的量为mol。
②673~723KCH3COOCH3平衡转化率几乎不变,其原因是。

①CO2在阴极上生成C2H5OH的电极反应式为。
②CO2转化为*CO的过程可描述为:溶液中的H2O在阴极表面得到电子生成*H。
+
→
+
→
|
化合物 |
CO2(g) |
CH3OH(g) |
H2O(g) |
|
摩尔生成焓/(kJ·mol-1) |
-395 |
-200 |
-242 |
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
①反应Ⅰ的焓变△H1=kJ·mol-1。
②保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2 , 起始及达平衡时,容器内各气体物质的量如表所示。
|
|
CO2 |
H2 |
CH3OH |
CO |
H2O |
|
起始量/mol |
4.0 |
8.0 |
0 |
0 |
0 |
|
平衡量/mol |
n1 |
3.0 |
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=,反应I的平衡常数Kp=。(无需带单位,用含p的式子表示)。
|
实验序号 |
温度(K) |
不同工程酶的组块 |
淀粉(g/L) |
|
1 |
T1 |
无 |
0.21 |
|
2 |
T1 |
agp-M1 |
0.38 |
|
3 |
T2 |
agp-M2 |
1.82 |
|
4 |
T2 |
agp-M3 |
1.24 |
①最佳的反应条件为
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能的原因是。
③实验4可用淀粉的质量浓度表示反应速率为g·L-1·h-1 , 淀粉的产率为(用含a的代数式表示)。
|
共价键 |
C-H |
C-O |
|
H-H |
O-H |
|
键能( |
413 |
358 |
839 |
436 |
467 |
由此可估算反应的焓变
。

①压强(填“>”“<”或“=”,下同)。判断依据是。
②a、b两点的平衡常数。
③已知Arrhenius经验公式为(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得下图所示曲线。在m催化剂作用下,该反应的活化能Ea=
。从图中信息获知催化效能较高的催化剂是(填“m”或“n”)。

温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
①该反应为(填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是。

①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。

4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH=-1268kJ·mol-1
2NO(g)N2(g)+O2(g)ΔH=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式。
①相对催化效率较大的催化剂是(填“Cat1”或“Cat2”)。
②在Cat1催化下,300℃时对应的状态(填“是”或“不是”)平衡状态,判断的依据是。
③在Cat1催化下,温度高于300℃时丙烯转化率急剧下降的主要原因可能是。(答一条即可)
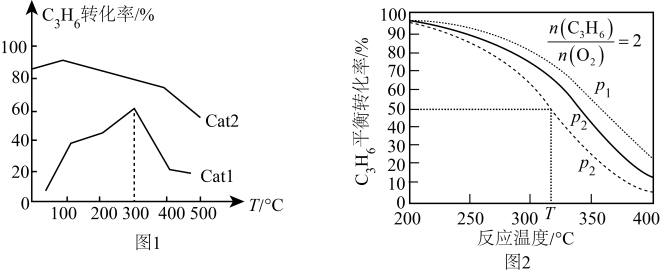
①其他条件相同,p1、p2、p3由大到小的顺序为。
②在p3、T℃时反应达到平衡,甲基环氧乙烷选择性为80%,此时容器体积为2L。
提示:甲基环氧乙烷选择性等于甲基环氧乙烷的物质的量与甲基环氧乙烷和丙醛总物质的量之比。
主反应的平衡常数K=。保持温度、容积不变,再充入0.5mol
和0.5mol
, 副反应(填“向正反应方向”、“向逆反应方向”或“不”)进行。

A.过渡态1比另两种过渡态稳定
B.三种反应历程中,N3反应速率最快
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.起始投料在刚性容器中分别采用三种途径反应相同时间,三种途径MTBE的产率一定相同

①T2时,反应90min后到达点B,此时甲醇的体积分数为(保留3位有效数字)
②A、B、M三点中,正反应速率最大的是,逆反应速率最小的是。
③比较A、B、M三点的平衡常数K(A)、K(B)、K(M),从大到小的顺序是。
④已知对于反应dD(g)+eE(g)gG(g)+hH(g),标准平衡常数Kθ=
, 其中PG、PH、PD、PE为各组分的平衡分压,分压=总压×该组分物质的量分数,pθ=100kPa。在T1时,将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为200kPa),甲醇的平衡分压为,反应的标准平衡常数Kθ=。