



实验操作和现象 | 实验结论 | |
A | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
B | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 | CF2Cl2是极性分子 |
C | 石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去 | 气体中含有乙烯 |
D | 用pH计分别测0.1molL-1NaClO和CH3COONa溶液的pH,前者pH大 | Ka(HClO)>Ka(CH3COOH) |



实验 | 实验操作和结果 |
1 | 向 |
2 | 向 |
3 | 向 |
4 | 向5 mL含有浓度均为0.01mol/L的Ag+和Ba2+的混合溶液中逐滴滴加实验3所得的溶液,有白色沉淀生成 |
下列有关说法正确的是( )


①
②
回答下列问题:


①完成化学方程式:
。
② 催化丙烷脱氢过程中,部分反应历程如图1,
过程的焓变为(列式表示)。

③ 可用于
的催化氧化。设计从
出发经过3步反应制备
的路线(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为。
(ⅰ)
(ⅱ)
①下列有关 溶液的说法正确的有。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量 溶液,反应(ⅰ)的平衡逆向移动
D.加入少量 固体,平衡时
与
的比值保持不变
② 时,
溶液中
随pH的变化关系如图2。当
时,设
、
与
的平衡浓度分别为x、y、z
,则x、y、z之间的关系式为
;计算溶液中
的平衡浓度(写出计算过程,结果保留两位有效数字)。

③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长( )有关;在一定波长范围内,最大A对应的波长(
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、
不同的
稀溶液,测得其A随
的变化曲线如图3。波长
、
和
中,与
的
最接近的是;溶液
从a变到b的过程中,
的值(填“增大”“减小”或“不变”)。
i.CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3(g) ΔH=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g) ΔH=-100kJ·mol-1
①写出相同条件下CH2=CHCH2Cl和HCl合成CH2ClCHClCH3的热化学方程式。
②已知①中的正反应的活化能E正为132kJ·mol-1 , 请在下图中标出①中逆反应的活化能E逆及数值。

①H2的转化率为
②T℃时该反应的平衡常数K=(列计算式表示)。

①写出上述转换中存在的主要反应的化学方程式。
②有人提出中间产物CO的处理,用反应2CO(g)=2C(s)+O2(g) ΔH>0来消除CO的污染,请用文字说明是否可行。
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
则反应 3CO2(g)+CH4(g)=4CO(g)+2H2O(g)的ΔH3=kJ·mol-1。

①CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH0(填“大于”或“小于”)。
②下列叙述能判断反应CO2(g)+CH4(g)=2CO(g)+2H2(g)达化学平衡状态的是。
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1 , 温度为1000℃时,反应经5min达平衡,用CO2表示的化学反应速率v(CO2)=;比较x点和y点的速率:xy(填“大于”“小于”或“等于”);压强p1P2(填“大于”“小于”或“等于”),原因是。
已知:
甲烷直接将 还原为
的热化学方程式为。
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有(写出一种即可)。
②此条件下达到平衡时,计算该反应的平衡常数 。
①常温下,相同浓度的 、
溶液中pH较大的是溶液。
②常温下, 显性(填“酸”“碱”或“中”),判断的理由是: (通过计算说明)。
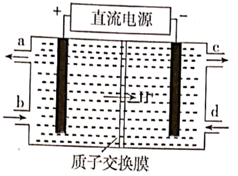
① 从电解槽的(填字母代号)口流出。
②写出阴极的电极反应式:。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式。

①a、b、c、d四点的平衡常数从大到小的顺序为。
②若 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为。

|
金属离子 |
开始沉淀的pH |
完全沉淀的pH |
|
| l. 8 | 3.2 |
| | 3.0 | 5.0 |
| | 5.8 | 8.8 |
| | 7.8 | 9.8 |



已知:ⅰ.二元酸在水中的电离方程式是:
,
。
ⅱ.的分布系数
a.溶液为红色
b.
c.
d.
a.盛装溶液的滴定管,未用
溶液润洗
b.盛装溶液的锥形瓶,用蒸馏水洗过后未用
溶液润洗
c.盛装溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失
d.滴定终点读数时,俯视滴定管的刻度
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
|
HCN |
H2CO3 |
CH3COOH |
|
Ka=4.9×10-10 |
Ka1=4×10-7 Ka2=5.6×10-11 |
Ka=1.7×10-5 |
弱电解质 |
|
|
|
电离平衡常数 |

则0~8min,用表示该反应速率为
。


①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满溶液;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的未干燥的锥形瓶中,加入2滴指示剂溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
a.配制标准溶液的固体NaOH中混有KOH杂质
b.中和滴定到达终点时俯视滴定管内液面读数
c.振荡时锥形瓶中溶液飞溅出来
d.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液


①列说法正确的是(填字母序号)。
A.该滴定过程若选择单一指示剂最好选择甲基橙
B.当V(NaOH)=V(H2A)时,溶液中存在:
C.pH=6.27时,c(HA-)=c(A2-)>c(H+)>c(OH-)
D.V(NaOH):V(H2A)=3:2时,
②常温下H2A的电离平衡常数Ka1=。
③当pH=6时mol/L。
④滴加至a、b、c三个交点处,溶液中水的电离程度由大到小依次为(用字母排序)。
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |