

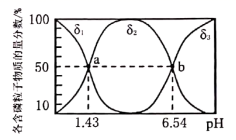
25℃时0.1 mol·L-1溶液中,H2A、HA-、A2-的分布分数 δ与pH的变化关系如图2所示。 已知: δ(A2-) =

下列说法错误的是( )


甲 乙
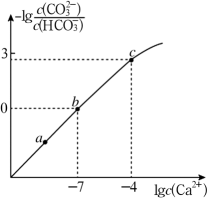
下列溶液中的关系中一定正确的是( )
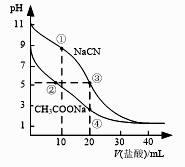


已知:①NaNO2具有毒性和强氧化性;②酸性强弱:H2SO3>HNO2>CH3COOH。
a.二氧化碳 b.二氧化硫 c.醋酸 d.稀硫酸
件下不与酸反应。以辉锑矿(主要成分为 Sb2S3 , 还含有 As2S5、PbS、CuO 和 SiO2等)为原料制备金属锑,其中一种工艺流程如下:

已知:①浸出液主要含 HCl 和 SbCl3 , 还含 SbCl5、CuCl2、AsCl3和 PbCl2等杂质。
②25℃时,Ksp (CuS)=1.0×10 -36 , Ksp (PbS)=9.0×10 -29。
回答下列问题:
① 为(填“正盐”或“酸式盐”),其溶液显碱性的离子方程式为。
② 点时,溶液中水电离出的
。
③所加 溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为。
④将浓度均为 的
和
的混合液加水稀释10倍后,溶液中
将(填“增大”、“减小”或“不变”)。
已知:I.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=-890.3kJ·mol-1;
II.N2(g)+2O2(g)=2NO2(g)ΔH2=+67.7kJ·mol-1
则CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(l)ΔH=。
①该反应在(填“较高”或“较低”)温度下能自发进行。
②一定温度下,向2L恒容密闭容器中充入2molCH4(g)和2molNH3(g),发生上述反应,10min末达到平衡状态,测得NH3的体积分数为30%。则0~10min内,用HCN的浓度变化表示的平均反应速率为;CH4的平衡转化率为;该温度下,该反应的平衡常数K=(mol/L)2
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量随时间的变化如图1所示。活化能最小的是[填“E(A)”“E(B)”或“E(C)”]。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图2所示。温度高于300℃,处理NO2的量随温度升高而减小的原因为(假设该温度范围内催化效率相同)。

在0~5min内,H2的平均反应速率v(H2)= 。
A.一定向正反应方向移动 B.平衡移动时,逆反应速率始终增大
C.一定向逆反应方向移动 D.平衡移动时,正反应速率始终减小
主反应:
副反应:
将反应物混合气体按进料比n(CO):n(H2)=1:3通入反应装置中,选择合适的催化剂,发生上述反应。
不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2的平衡转化率随温度的升高而增大的原因是。实际生产中,保持压强不变,相对反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是。

合成氨工厂常用碳酸钾溶液吸收混合气中的CO2 , 从而实现CO2的减排。
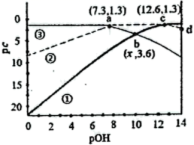
a. c(K+)+c(H+)=c(CO )+c(HCO
)+c(OH-)
b. 3c(K+)=4c(CO )+4c(HCO
)+4c(H2CO3)
c. c(K+)>c(OH-)>c(HCO )>c(CO
)>c(H+)
①写出该反应的平衡常数表达式 K=。
②该热化学方程式的意义是。
③实际生产中通过热交换器,把反应产生的热量及时导出用来预热进入转化器的原料气。该方法既加快了反应速率,又促使化学平衡向生成 SO3 的方向移动。请结合反应说明这样操作的原理。

①反应处于平衡状态的时间是。
②反应进行至 20 min 时,曲线发生变化的原因是。
③工业制硫酸排出的尾气中的 SO2 可以用氨水吸收, 最终得到 NH4HSO3 溶液,写出该溶液中的电荷守恒的表达式为。
①已知CO(g)、S(l)的燃烧热分别为283kJ•mol-1、529kJ•mol-1 , 则反应SO2(g)+2CO(g) S(l)+2CO2(g)的△H=
②一定压强下,发生反应2CO(g)+SO2(g) S(1)+2CO2(g),平衡时SO2的转化率α(SO2)与投料比的比值[
=y]、温度T的关系如图所示。则平衡时,CO的转化率:NM(填“>”、“<”或“=”,下同),逆反应速率:NP。

③某温度下,向1L密闭容器中充入2molCO和1molSO2 , 发生反应:2CO(g)+SO2(g) S(1)+2CO2(g),达到平衡后,测得混合气体中CO2的物质的量为1.2mol。则该温度下反应的平衡常数K=


①为提高SO2的吸收效率η。可采取的措施有:增大悬浊液中ZnO的量、适当提高单位时间内烟气的循环次数、
②图1中的pH-t曲线ab段主要反应的化学方程式为
③pH=7时,溶液中 =

①阴极的电极反应式为
②每处理含19.2gSO2的烟气,理论上回收S、H2SO4的物质的量分别为、。
水煤气还原法
已知:i.2CO(g)+SO2(g) S(l)+2CO2(g) △H1=—37.0kJ·mol-1
ii.2H2(g)+SO2(g) S(l)+2H2O(g) △H2=+45.4kJ·mol-1
写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式为。
①步骤1:用足量氨水吸收SO2 , 试写出该反应的化学方程式。
②步骤2:再加入熟石灰的反应,试写出该反应离子方程式。
③已知:25℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=(用含a、b的代数式表示)。

Ka1(H2SO3)=。
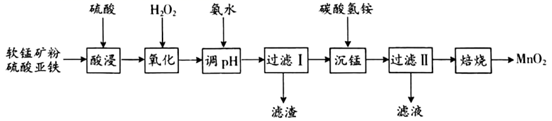
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
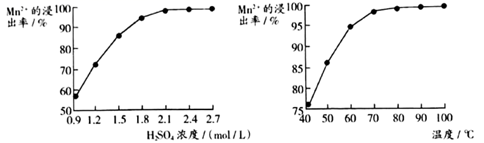
①“沉锰”过程中放出CO2 , 反应的离子方程式为。
②“沉锰”过程中沉锰速率与温度的关系如图所示。

当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是。
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=kJ•mol−1(用含m、n、p的代数式表示)。