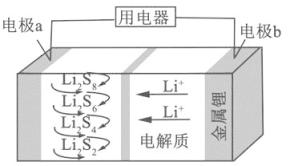
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )

下列化学反应表示正确的是
实验装置 | 实验现象 | |
| I.a为AgCl | II.a为AgI |
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明 | 两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色 | |
下列说法错误的是

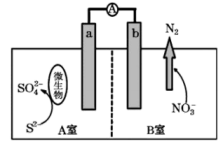






 下列说法正确的是( )
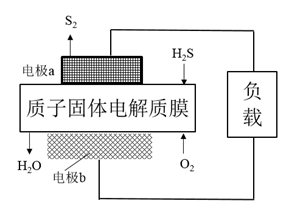
下列说法正确的是( )



①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g)N2O4(g) △H2<0

①下列情况能说明体系达到平衡状态的是(填字母)。
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为MPa·min-1。在该温度下2NO2(g)N2O4(g)的平衡常数Kp=(MPa)-1(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得正=
(NO2)消耗=k正c2(NO2),
逆=2
(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=。若将容器的温度改变为T2时,其k正=10k逆 , 则T1T2(填“>”“<”或“=”)。



①催化分解制氢的过程可描述为。
②的水溶液呈弱碱性。研究发现:向
溶液中加入适量
或
, 能明显促进上述催化分解反应的进行。其原因可能是。
 +H2O+H2SO4
+H2O+H2SO4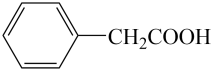 +NH4HSO4
+NH4HSO4
 +Cu(OH)2
+Cu(OH)2 +H2O
+H2O
制备苯乙酸的装置示意图(加热和夹持装置等略):
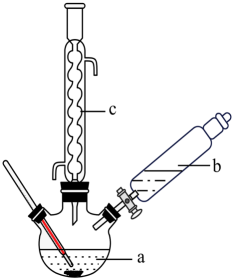
已知:苯乙酸![]() 的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
i.在250mL三颈烧瓶a中加入70mL70%的硫酸。
ii.将a中的溶液加热至100℃,缓缓滴加40g苯乙腈(![]() )到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
)到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
iii.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。回答下列问题:


则反应在0.5MPa,550℃时的α=,判断的依据是,影响α的因素有(答出一点即可)。

则b为电源极(填“正”或“负"),电路中转移0.4mol电子可捕获CO2的体积(标况下)为L。

已知:①As2O3为酸性氧化物;②As2S3易溶于过量的Na2S溶液中,故加入FeSO4 , 的目的是除去过量的S2-。
回答下列问题:


已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RHNiR2+2H+。
回答下列问题:
电解电压/V | 1.0 | 1.2 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
Fe2+ | 有 | 有 | 有 | 无 | 无 | 无 | 无 |
Cr4+ | 无 | 无 | 无 | 无 | 无 | 有 | 有 |
A.酸浸 B.调pH C.除Cr
反萃取剂X为 (填化学式)。


已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度及开始沉淀的pH
金属离子 | 浓度(mol·L-1) | 开始沉淀pH |
Fe2+ | 1.0×10-3 | 8.0 |
Fe3+ | 4.0×10-2 | 1.7 |
Zn2+ | 1.5 | 5.5 |
Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
金属离子 | 萃取率(%) |
Fe2+ | 0 |
Fe3+ | 99 |
Zn2+ | 0 |
Ga3+ | 97-98.5 |
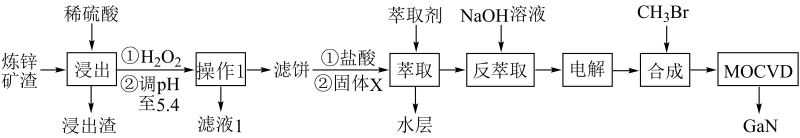
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度 及开始沉淀的pH
金属离子 | 浓度( mol· L-1) | 开始沉淀pH |
Fe2+ | 1.0×10-3 | 8.0 |
Fe3+ | 4.0×10-2 | 1.7 |
Zn2+ | 1.5 | 5.5 |
Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
金属离子 | 萃取率(%) |
Fe2+ | 0 |
Fe3+ | 99 |
Zn2+ | 0 |
Ga3+ | 97-98.5 |

回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2 , Ksp(PbCO3)=7.4×10-14mol2·L-2 , 1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为;“还原酸浸”过程中主要反应的离子方程式为。
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是;将分离出晶体的母液收集、循环使用,其意义是。
③整个流程中可循环利用的物质是;加入Na2CO3溶液的目的是将PbSO4转化为PbCO3 , Na2CO3溶液的最小浓度为mol·L-1(保留一位小数);PbSO4(s)+(aq)⇌PbCO3(s)+
(aq),平衡常数K=(列出计算式)。

①交换膜1为交换膜(选填“阴离子”、“阳离子”);电路中通过2mol电子时,理论上回收gNaOH。
②b电极上发生反应的电极反应式为。