实验目的 | 实验方法或操作 | |
A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 |
C | 判断反应后 | 将 |
D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |
实验 | V/mL | t/s | |||
|
| 醋酸 | 水 | ||
1 | 4.0 | 4.0 | 8.0 | 332 | |
2 | 6.0 | 4.0 | 4.0 | 6.0 | 148 |
3 | 4.0 | 4.0 | 4.0 | 83 | |
4 | 12.0 | 4.0 | 4.0 | 37 | |
选项 | A | B | C | D |
目的 | 制取无水 | 检验产生的 | 证明 | 探究化学反应速率的影响因素 |
实验方案 |
|
|
|
|
|
|
|
|
A.检验乙炔的还原性 | B.加热金属钠,观察钠燃烧现象 | C.配制银氨溶液 | D.探究浓度对化学反应速率的影响 |
实验I.取一定量的甲苯与一定体积和一定浓度的高锰酸钾水溶液,混合,振荡10min,缓慢褪色。
实验Ⅱ.在实验I的试剂取量基础上,再加入120g/L的冠醚(18-冠-6),振荡,4.5min褪色。
下列有关说法错误的是
选项 | 探究方案 | 实验目的 |
A | 向2mL1mol·L-1CH3COOH溶液中滴加1mol·L-1Na2CO3溶液,观察现象 | 比较Ka(CH3COOH)和Ka1(H2CO3)的大小 |
B | 向4mL0.1mol·L-1CuSO4溶液中滴加1mol·L-1氨水至沉淀溶解,再加入8mL95%乙醇,过滤 | 制备[Cu(NH3)4]SO4•H2O晶体 |
C | 把两个体积相同、封装有等量NO2和N2O4混合气体的烧瓶分别同时浸泡在热水和冰水中,观察混合气体的颜色变化 | 探究温度对化学平衡的影响 |
D | 向溶液X中滴加少量稀硝酸,然后滴入几滴Ba(NO3)2溶液,观察现象 | 检验溶液X是否含有SO |
目的 | 方案设计 | 现象和结论 | |
A | 测定常温下某NaOH溶液的pH | 用胶头滴管将待测液滴在湿润的pH试纸上,与标准比色卡对照 | 测得pH为13 |
B | 探究苯酚和溴水的反应 | 取5mL10%苯酚的水溶液于试管中,滴加2~3滴稀溴水 | 未观察到产生白色沉淀,说明苯酚不能与溴水反应 |
C | 探究氯水能否漂白硫氰化铁溶液 | 往2mL |
|
D | 探究催化剂对 | 在相同条件下向一支试管中加入2mL5% | 可观察到后者产生气泡速度更快,说明 |
a.(观察气泡产生的快慢)
b.(观察浑浊产生的快慢)
反应 | 影响因素 | 所用试剂 | |
A | a | 接触面积 | 块状CaCO3、0.5 mol/L HCl 粉末状CaCO3、0.5 mol/L HCl |
B | a | H+浓度 | 块状CaCO3、0.5 mol/L HCl 块状CaCO3、3.0 mol/LHCl |
C | b | H+浓度 | 0.1 mol/L Na2S2O3、稀H2SO4 0.1mol/L Na2S2O3、浓H2SO4 |
D | b | 温度 | 0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、冷水 0.1 mol/L Na2S2O3、0.1 Na2S2O3 H2SO4、热水 |
选项 | 实验目的 | 实验操作 |
A | 制备无水AlCl3 | 蒸发Al和稀盐酸反应后的溶液 |
B | 验证结合H+的能力:CO | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
C | 验证可溶性MR为强酸强碱盐 | 25℃,测得MR溶液的pH=7 |
D | 探究浓度对反应速率的影响 | 向2支各盛有5mL不同浓度的NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
选项 | 实验目的 | 实验设计 |
A | 除去CH4中的CH2=CH2 | 气体依次通过盛有高锰酸钾溶液、浓硫酸的洗气瓶 |
B | 测定次氯酸钠溶液的pH | 将待测液滴在湿润的pH试纸上,再与标准比色卡对照 |
C | 探究浓度对化学反应速率的影响 | 取大小、形状、质量相同的Cu粒分别投入稀硝酸和浓硝酸中 |
D | 制取H2 | 向稀硫酸中加入Zn和少量Cu单质 |

分组 | 温度/℃ | pH | c(Mn2+)/mol·L-1 |
① | 60 | ≈7 | 0.00002 |
② | 60 | 12 | 0 |
③ | 60 | 13 | 0 |
④ | 60 | 11 | 0.00002 |
⑤ | 70 | 13 | 0 |
下列说法不正确的是( )
选项 | 证据 | 推理 |
A | 向FeCl3溶液中加入几滴30%的H2O2溶液,产生气体的速率加快,一段时间后,液体颜色加深 | Fe3+能催化H2O2的分解,且该分解反应为放热反应 |
B | 室温下,将BaSO4固体投入饱和碳酸钠溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生 | Ksp(BaSO4)>Ksp(BaCO3) |
C | 将Fe(NO3)2晶体溶于稀硫酸中,滴入几滴KSCN溶液,溶液呈红色 | Fe(NO3)2晶体已变质 |
D | 室温下,用pH试纸测得0.1moL/L碳酸钠溶液的pH等于10,测得0.1mol/LCH3COONa溶液的pH等于9 | 酸性:CH3COOH强于H2CO3 |
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在 |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5 min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 向2支盛有2 mL0.01 mol/LH2C2O4溶液的试管中分别加入4 mL0.01 mol/L和0.02 mol/LKMnO4溶液,观察现象 | 可说明浓度越大,反应速率越快 |
| 选项 | 实验方案 | 实验目的或结论 |
| A | 向20%蔗糖溶液中加入少量稀H2SO4 , 加热;再加入银氨溶液,未出现银镜 | 蔗糖未水解 |
| B | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入溴水中,褪色 | 证明溴乙烷的消去反应有乙烯生成 |
| C | 用两支试管各取5mL0.1mol·L-1的KMnO4溶液,分别加入2mL0.1mol·L-1和0.2mol·L-1的草酸溶液,记录溶液褪色所需的时间 | 探究浓度对化学反应速率的影响 |
| D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol·L-1FeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| 选项 | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液 | 探究浓度对反应速率的影响 |
| C | 常温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaF溶液和NaClO溶液的pH | 比较HF与HClO的酸性强弱 |
| D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成红棕色的NO2能溶于浓硝酸 |
| 实验编号 | ① | ② | ③ | ④ |
| 溶液种类 | 1 | 0.5 | 0.1 | |
| | 0.48 | 0.48 | 0.48 | 0.48 |
| V(溶液) | 100 | 100 | 100 | 100 |
| 实验现象 | 有气体产生,并产生白色沉淀 | 有气体产生,并产生白色沉淀 | 有气体产生,并产生白色沉淀 | 几乎看不到现象 |
| 6h时 | 433 | 255 | 347 | 12 |
根据上述实验所得结论正确的是( )
| A | B | C | ||
| 目的 | 研究浓度对化学平衡的影响 | 研究反应物之间的接触面积对化学反应速率的影响 | 制备氢氧化铁胶体 | 实验室制备并收集乙酸乙酯 |
| 实验方案 | | | | |
在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:

装置A中盛放甲酸的仪器的名称是。
将通入新制银氨溶液中,有黑色沉淀生成。
将一定量与空气混合,得到
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
, 按一定流速通入气体样品。(已知:
是白色固体,易吸水潮解:
)

通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
。
①能证明被空气氧化的现象是;
②被催化氧化的百分率为;
③若未通入氮气,②的结果将(填“偏大”“偏小”或“无影响”)。
|
实验 |
碱 |
溶剂 |
催化剂 |
产率/% |
|
① |
KOH |
DMF |
Pd(OAc)2 |
22.3 |
|
② |
K2CO3 |
DMF |
Pd(OAc)2 |
10.5 |
|
③ |
Et3N |
DMF |
Pd(OAc)2 |
12.4 |
|
④ |
六氢吡啶 |
DMF |
Pd(OAc)2 |
31.2 |
|
⑤ |
六氢吡啶 |
DMA |
Pd(OAc)2 |
38.6 |
|
⑥ |
六氢吡啶 |
NMP |
Pd(OAc)2 |
24.5 |
上述实验探究了和对反应产率的影响。此外,还可以进一步探究等对反应产率的影响。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
 ,写出合成路线。(无机试剂任选)
,写出合成路线。(无机试剂任选)
实验操作:向小试管中加入溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
。
已知:可与
发生反应:
。为了进一步探究
与
的反应速率,小组同学设计下表实验:
试验编号 |
|
| 蒸馏水/ | 0.4%的淀粉溶液/滴 |
| 变色时间/ |
Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
Ⅱ | 4.0 | 1.0 | 3.0 | 2 | 2.0 | 30 |
加入溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:先与
反应,
消耗完后才与
反应;
猜想2:与
反应的速率远低于
与
反应的速率。
为验证上述猜想,小组同学补充下表实验:
试验编号 |
|
|
| 0.4%的淀粉溶液/滴 |
| 实验现象 | |
Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
已知:
i.(NH4)2S2O8具有强氧化性,能完全电离,S2O易被还原为SO
;
ii.淀粉检测I2的灵敏度很高,遇低浓度的I2即可快速变蓝;
iii.I2可与S2O发生反应:2S2O
+I2=S4O
+2I-。
|
编号 |
1-1 |
1-2 |
|
实验操作 |
|
|
|
现象 |
无明显现象 |
溶液立即变蓝 |
为了研究(NH4)2S2O8与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
|
编号 |
0.2mol·L-1KI溶液/mL |
0.01mol·L-1Na2S2O3溶液/mL |
蒸馏水/mL |
0.4%的淀 粉溶液/滴 |
0.2mol·L-1(NH4)2S2O8溶液/mL |
变色时间/s |
|
2-1 |
2 |
0 |
2.8 |
2 |
0.2 |
立即 |
|
2-2 |
2 |
0.8 |
0.2 |
2 |
2 |
30 |
猜想1:(NH4)2S2O8先与Na2S2O3反应,使c(S2O)降低;
猜想2:(NH4)2S2O8先与KI反应,..............。
①甲同学提出猜想1的依据:由信息iii推测,Na2S2O3的还原性(填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是。
③补全猜想2:。
写出制备反应的离子方程式:。
|
序号 |
操作 |
实验现象 |
|
实验i |
|
滴入硝酸后,溶液变为红色,一段时间后,溶液褪为无色。 |
依据“溶液变为红色”的现象推断Fe2+被氧化,推断理由是。
|
序号 |
操作 |
实验现象 |
|
实验ii |
取少量反应结束后的溶液滴加氯化钡溶液 |
产生白色沉淀 |
补全反应:3SCN-+13NO +
![]() =
= ![]() +3CO2↑+16NO↑+
+3CO2↑+16NO↑+ ![]() 。
。
|
序号 |
操作 |
实验现象 |
|
实验iii |
|
滴入FeSO4后,溶液变为红色,静置,t1时刻后溶液红色恰好褪去。 |
|
实验iv |
|
①某同学依据实验iii的现象得出结论:该条件下,HNO3氧化Fe2+的速率比氧化SCN-的速率快,该结论是否合理,请说明理由。
②对比实验iii、iv现象得出结论:该条件下,在t1时刻内,HNO3浓度降低后,仍可氧化Fe2+ , 但不能氧化SCN-。实验iv的现象是。
甲同学推测加快速率的粒子有两种:
① 能加快化学反应速率。
② 能加快化学反应速率。
为验证猜想,进行了如下实验:
| 对照组 | 1mol/L | 持续产生大量气泡,溶液略显浑浊 |
| 实验组1 | 1mol/L | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 1mol/L | 镁表面有极微量气泡附着 |
已知:Mg和 反应只能看到镁条表面有极微量气泡附着。用离子方程式解释对照组中
溶液显碱性的原因;实验组1得到的结论是;为控制变量与对照组一致,实验组2应在1mo/L
溶液中。
乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为。经查阅文献得知, 溶液可以通过自耦电离
产生
,该反应的平衡常数为(保留3位有效数字)。(已知:
电离常数
,
)
| 实验组3 | 取6mL1mol/L |
| 实验组4 | 取6mL1mol/L |
| 实验组5 | 用上述同样方法采集15min空塑料瓶中 |

由图像可知,加入Mg条后, 释放受到抑制,原因是;实验时取少量
溶液、少量镁条的原因是。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3 K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3 K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3 , 写出生成Ag(NH3)2NO3的化学方程式。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。

实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是。
实验 | 实验操作 | 实验现象 |
Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁立即出现银镜 |
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是也参与了还原
。经检验该假设成立,实验方案及现象是。
【设计实验】
|
序号 |
|
|
|
反应温度/℃ |
|
① |
2.0 |
2.0 |
0 |
20 |
|
② |
2.0 |
1.0 |
1.0 |
20 |
a.盐酸 b.硫酸 c.草酸
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)无色,在草酸中不能形成配合物;
(b)无色,有强氧化性,发生反应
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
和
。
乙同学从氧化还原角度推测阶段i中可能产生 , 你认为该观点是否合理,并说明理由:。
进一步实验证明溶液中含有 , 反应过程中
和
浓度随时间的变化如下图。

第i阶段中检测到有气体产生,反应的离子方程式为。
上述实验涉及的反应中,草酸的作用是。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
实验序号 | 实验温度(K) | 酸性KMnO4溶液 | 草酸溶液 | 水 | 溶液褪色时间 | ||
c(mol/L) | V(mL) | c(mol/L) | V(mL) | V(mL) | t(s) | ||
① | 298 | 0.02 | 2.0 | 0.10 | 4.0 | 0 | t1 |
② | T | 0.02 | 2.0 | 0.10 | 3.0 | a | 8.0 |
③ | 343 | 0.02 | 2.0 | 0.10 | 3.0 | a | t2 |
④ | 373 | 0 | 2.0 | 0.10 | 3.0 | a | t3 |
S(s)+ O2(g)=SO2(g) △H2
2S(s) S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g) 2H2(g)+ S2(g)的△H=
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:2H2S(g) 2H2(g)+ S2(g) ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。

①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=。
②温度升高,平衡向方向移动(填“正反应”“逆反应”),平衡常数(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是。

①进入电解池的溶液中,溶质是。
②阳极的电极反应式为。
③电解总反应的离子方程式是。
a.石英
b.氧化铝
c.硅酸盐陶瓷
d.铁
已知H2的燃烧热△H= -285.8kJ/mol,N2(g) +O2(g)=2NO(g) △H= + 180kJ/mol。一定条件下,H2还原NO生成液态水和一种无毒物质的热化学方程式为。
工业上用NO和Cl2化合制备重要的合成用试剂NOCl( 亚硝酰氯)气体。
NOCl中N 元素的化合价为,NOCl的电子式为。

①该反应的△H0(填“>"或“<”或“=”),理由是。
②温度T1时,Cl2(g)在0~20min的平均反应速率为mol/(L·min)。
③温度T2时,该反应的平衡常数K=(结果保留小数点后2位)。若反应在T2达到平衡后,再向容器中充入2molNO(g)和1molCl2(g),当再达平衡时,c(NOCl)=(填“>”或“<”或“一”)1mol/L。
用下图所示装置可以模拟消除NO2获得铵态氮肥的过程。

该装置阳极电极反应式为。

该小组同学用右图装置电解1mol•L-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的,通电5分钟后,阳极无明显现象,证实乙同学的推论错误。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验(操作和现象),进一步证实了乙同学的推论错误。
实验 | 条件 | 操作及现象 | ||
电压 | pH | 阳极 | 阴极 | |
Ⅰ | 1.5v | 4.91 | 无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体 | 无气泡产生,4分钟后电极表面有银灰色金属状固体附着 |
Ⅱ | 1.5v | 2.38 | 无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色 | 无气泡产生,电极表面有银灰色金属状固体附着 |
Ⅲ | 1.5v | 1.00 | 无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色 | 有气泡产生,无固体附着 |
Ⅳ | 3.0v | 4.91 | 无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生 | 极少量气泡产生,1分钟出现镀层金属 |
Ⅴ | 6.0v | 4.91 | 有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊 | 大量气泡产生,迅速出现镀层金属 |
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以。
实验中所用的草酸为稀溶液,可视为强酸.
2MnO4﹣+C2O42﹣+=2 Mn2++CO2↑+H2O
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率.
但分析实验数据,得到的结论是.
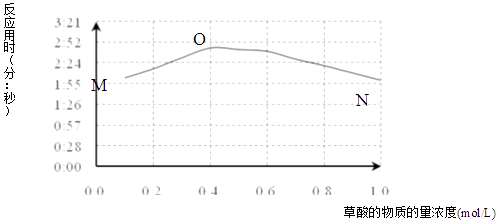
①用文字描述曲线图表达的信息.
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是.
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
c | 草酸稳定性较差,加热至185℃可分解. |
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10﹣3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是.
实验 编号 | 温度/K | 盐酸浓度 /mol•L﹣1 | 醋酸浓度/mol•L﹣1 | 实验目的 |
① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些. | |
② | 308 | 0.20 | ||
③ | 298 | 0.40 | ||
④ | 0.20 | |||
⑤ | 0.20 |

Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:

该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是.
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
③若该小组同学提出的假设成立,应观察到现象.