第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
反应I:
反应II:
在固定的原料比及体系压强不变的条件下,同时发生反应I、II,平衡时部分物质的物质的量分数随温度的变化如图所示。

下列说法正确的是( )
容器 | T/℃ | 物质的起始浓度/( | 物质的平衡浓度 | ||
Ⅰ | 1.00 | 0 | 0 | 0.85 | |
Ⅱ | 0 | 1.00 | 1.00 | x | |
Ⅲ | 2.00 | 0 | 0 | 1.60 | |
下列说法错误的是( )


平衡状态 | ① | ② | ③ |
容器体积/L | 40 | 20 | 1 |
c(A)( mol·L-1) | 0.022a | 0.05a | 0.75a |
下列分析错误的是( )
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]() ⇌
⇌ ![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )

一定条件下存在反应:2SO2(g)+O2 (g)═2SO3(g),其正反应放热.现有三个体积相同的密闭容器 I、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )


简要步骤如下:
Ⅰ.在瓶A中加入液氨和
, 通入氨气排尽密闭体系中空气,搅拌。
Ⅱ.加入钠粒,反应,得
粒状沉积物。
Ⅲ.除去液氨,得产品。
已知:几乎不溶于液氨,易与水、氧气等反应。
请回答:
准确称取产品→→→→计算
a.准确加入过量的水
b.准确加入过量的标准溶液
c.准确加入过量的标准溶液
d.滴加甲基红指示剂(变色的范围4.4~6.2)
e.滴加石蕊指示剂(变色的范围4.5~8.3)
f.滴加酚酞指示剂(变色的范围8.2~10.0)
g.用标准溶液滴定
h.用标准溶液滴定
i.用标准溶液滴定
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
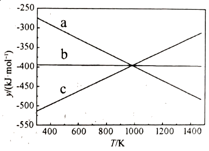
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比。
A.不变 B.增大 C.减小 D.无法判断
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。
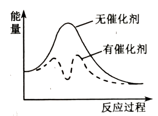
用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:;步骤Ⅱ:。
①称取 ,配成
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
可供选择的试剂: 、
、
、
、饱和
、饱和
可供选择的发生装置(净化装置略去):
CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应.
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).根据A点数据,计算出该转化反应的平衡常数为.
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H(填“大于”“小于”或“等于”).
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol﹣1 Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol﹣1和﹣285.8kJ•mol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJ•mol﹣1
请回答(不考虑温度对△H的影响):
在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图.
积碳反应: CH4(g) = C(s) + 2H2(g) ΔH= +75 kJ·mol-l
消碳反应: CO2(g) + C(s)= 2CO(g) ΔH= +172 kJ·mol-1
则CH4—CO2催化重整反应的热化学方程式为;
②反应中催化剂的活性会因积碳反应而降低,消碳反应则使积碳量减少。
催化剂 | 积碳反应活化能/kJ·mol-1 | 消碳反应活化能/kJ·mol-1 |
X | al | b1 |
Y | a2 | b2 |
若催化剂X优于催化剂Y,则a1与a2 , b1与b2的最佳关系为a1 a2 , b1b2 (填“>”“<”或“=”)。
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①降低温度,化学平衡向 (填“正反应”或“逆反应”)方向移动,原因是;
②某温度下,平衡浓度符合如下关系: c(CO2) c (H2) = c (CO) c (H2O),在此温度下,若该容器中含有0.8 mol CO2、1.0 mol H2、1.2 mol CO、1.2 mol H2O(g),则此时v正v逆(填“>”“<”或“=”)。

已知:i.
ii.
①过程I反应的化学方程式为。
②该技术总反应的热化学方程式为。
③反应i甲烷含量随温度变化如图1,图中 四条曲线中的两条代表压强分别为
时甲烷含量曲线,其中表示
的是

I.
II.
在一密闭体积可变容器中,通入 和
发生甲烷的水蒸汽重整反应。
①反应I的平衡常数的表达式为。
反应II平衡常数
(填“>”“<”或“=”)。
②压强为 时,分别在加
和不加
时,平衡体系
的物质的量随温度变化如图2所示。温度低于700℃时,加入
可明显提高混合气中
的量,原因是。

Ⅰ.
平衡常数K1
Ⅱ.
平衡常数
Ⅲ.
平衡常数K3
平衡常数K与温度T的函数关系为 ,
,
, 其中x、y、z为常数,则反应Ⅰ的活化能Ea(正)Ea(逆)(填“>”或“<”),
的数值范围是。

①其他条件不变,在范围内升高温度,出口处氮氧化物的量(填“增大”或“减小”),
的平衡转化率(填“增大”或“减小”)。
②需研发(“高温”或“低温”)下的选择性高的催化剂,能更有效除去尾气中的
。
时间/min | 0 | 30 | 60 | 120 | 180 | |
200℃ | 物质a的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
物质b的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
300℃ | 物质a的分压/ kPa | 100 | 69.0 | 48 | 48 | 48 |
物质b的分压/ kPa | 10 | 25.5 | 36 | 36 | 36 | |
该反应的0(填“>”或“<”),物质a为(填“CO”或“
”),200℃该反应的化学平衡常数
。
提高乙烷平衡转化率的措施有、。
a.2C2H6(g)+ O2(g)= 2C2H4(g) + 2H2O(g) △H2<0
b.2C2H6(g) + 5O2(g)= 4CO(g) + 6H2O(g) △H3<0
c.C2H4(g)+ 2O2(g)= 2CO(g) + 2H2O(g) △H4<0
根据盖斯定律,反应a的△H2= (写出代数式)。

①乙烯的物质的量百分数随温度升高而降低的原因是。
②在570~600℃温度范围内,下列说法正确的有(填字母)。
A.C2H4产率随温度升高而增大
B.H2O的含量随温度升高而增大
C.C2H6在体系中的物质的量百分数随温度升高而增大
D.此催化剂的优点是在较低温度下降低CO的平衡产率
③某学者研究了生成C2H4的部分反应历程如下图所示。写出该历程的总反应方程式。该历程的催化剂是。

I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1

①图1中c线对应的产物为(填“CO2”、“H2”或“CH4”)。
②图2中B点H2的产率与A点相等的原因是。

①出生成CO(g)步骤的化学方程式。
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有(填标号)。
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积
主反应:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H=+49 kJ·mol-1
副反应:H2(g)+CO2(g)CO(g)+H2O(g) △H=+40 kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是。
②若上述副反应的活化能Ea1=w kJ·mol-1 , 则CO(g)+H2O(g)H2(g)+CO2(g)的活化能Ea2=kJ·mol-1。
③某温度下,将n(H2O)∶n(CH3OH)=1∶1的原料气分别充入密闭容器中(忽略副反应),设恒容下甲醇的平衡时转化率为α1 , 恒压条件下甲醇的平衡时转化率为α2 , 则α1α2(填“>”、“<”或“=”)。

压强为p1时,在N点:v正v逆(填“>”、“<”或“=”),N点对应温度下该反应的逆反应的平衡常数K= L2·mol-2。比较:p1p2(填“>”、“<”或“=”)。

①HCOOD催化释氢反应除生成HD外,还生成(填化学式)。
②研究发现:其他条件不变时,HCOOK替代一部分HCOOH,催化释氢的速率增大,根据图示反应机理解释其可能的原因是。
在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(1),放出19.14kJ的热量。写出该反应的热化学方程式。
写出该反应的平衡常数表达式K=。已知:在一定温度下的密闭容器中,该反应已达到平衡。保持其他条件不变,下列措施能提高NO2转化率的是。
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
实验操作 | 实验现象 |
取少量Na2CO3固体,加入无水酒精,充分振荡、静置 | 溶液为无色 |
取上层清液于试管中,滴加酚酞试剂 | 溶液为无色 |
在试管中继续加入少量水 | 溶液变为红色 |
向该红色溶液中滴加足量BaCl2溶液(中性) | 红色褪去 |
①该实验表明,Na2CO3溶液显碱性的原因是(请结合化学用语,简要说明)。
②从形成盐的酸和碱的强弱角度看,Na2CO3属于盐。
③为了使Na2CO3溶液中的比值变小,可适量加入(或通入)的物质是。
a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
物质 | |||
燃烧热 | 890.3 | 1411 | 285.8 |
.

 B.
B. C.
C. D.
D.
已知:①CO(g)+H2O(g) HCOOH(g) △H1=−72.6kJ·mol−1
②2CO(g)+O2(g) 2CO2(g) △H2=−566.0kJ·mol−1
则反应③的平衡常数表达式K= , 写出反应③的热化学方程式。
i.СО2(g)+Н2(g) НСООН(g) △H3<0
ii.CO2(g)+H2(g) CO(g)+H2O(g) △H4
刚性密闭容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。(选择性是指转化成目标产物的反应物在实际消耗的反应物中的占比)

①曲线a随温度升高而下降的原因是;为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为(填标号)。
A. 低温、低压 B.高温、高压 C.高温、低压 D.低温、高压
②240℃时,容器内压强随时间的变化如下表所示:
时间/min | 0 | 20 | 40 | 60 | 80 |
压强/MPa | p0 | 0.91p0 | 0.85p0 | 0.80p0 | 0.80p0 |
反应i的速率可表示为υ=k·p(CO2)·p(H2)(p为气体分压,分压=总压×气体的物质的量分数, k为常数),则反应在60 min时υ=(用含p0、k的式子表示)。
在密闭容器中通入物质的量均为0.2mol的CH4和CO2 , 在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率与温度及压强的关系如图所示。

①由如图可知:压强p1p2(填“>”、“<”或“=”)。
②Y点:υ(正)υ(逆)(填“>”、“<”或“=”)。
反应I:主反应CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1 Kp1
反应II:副反应CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 Kp2
反应III:积碳反应2CO(g)CO2(g)+C(s) ΔH3 Kp3
反应IV:积碳反应CH4(g)C(s)+2H2(g) ΔH4 Kp4


①图中对应T=800℃下,x(CH4)随压强p的变化曲线是,判断的理由是。
②若x(CH4)=0.1.则CO2的平衡转化率为。