
已知:25℃草酸和碳酸的电离平衡常数数值如下表。
电离平衡常数 | ||
已知:酸性条件下Cu+不稳定
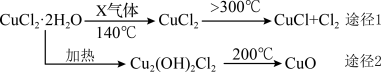
下列说法错误的是


已知:①“酸浸”后为VO2∙xH2O转化为VO2+;
②Cr(OH)3的Ksp近似为1×10-31;下列说法正确的是

已知:“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。下列说法正确的是


下列说法正确的是( )
选项 | 实验目的 | 实验操作 |
A | 除去乙醇中的少量乙酸 | 加入适量 |
B | 实验室制备少量 | 在沸腾的蒸馏水中滴加几滴饱和 |
C | 鉴别 | 分别向盛有两种溶液的试管中滴加浓溴水 |
D | 检验淀粉是否水解完全 | 取水解后的混合液,向其中加入新制的 |
“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
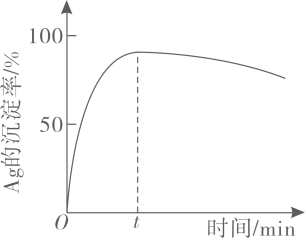
一定温度下,
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①,②(填操作名称),③称量等操作,测得所得固体氧化物质量为
, 从下列仪器中选出①、②中需使用的仪器,依次为(填标号)。测得样品纯度为(用含
、
的代数式表示)。

已知:常温下,。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
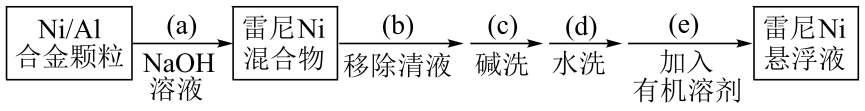
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
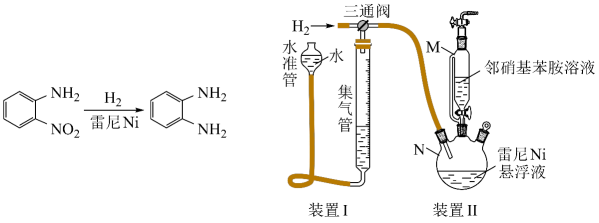
回答下列问题:


已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:

用(称量样品
)→用烧杯()→用( )→用移液管()→用滴定管(盛装
标准溶液,滴定
)
仪器:a、烧杯;b、托盘天平;c、容量瓶;d、分析天平;e、试剂瓶
操作:f、配制一定体积的Zn2+溶液;g、酸溶样品;h、量取一定体积的溶液;i、装瓶贴标签
某研究小组取人血浆铜蓝蛋白(相对分子质量
),经预处理,将其中
元素全部转化为
并定容至
。取样测得荧光强度比值为10.2,则1个血浆铜蓝蛋白分子中含个铜原子。

(水层)+3HA(有机层)
(有机层)+
(水层)
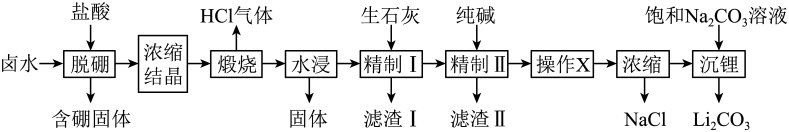
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是。
②反萃取的目的是将有机层转移到水层。使
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有(填化学式)。


已知:金属离子形成氢氧化物沉淀的pH范围[ pH =8.5时Al(OH)3开始溶解]
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ |
开始沉淀时pH | 3.4 | 2.7 | 7.6 | 11.3 |
完全沉淀时pH | 4.7 | 3.7 | 9.6 |
回答下列问题:
![]()
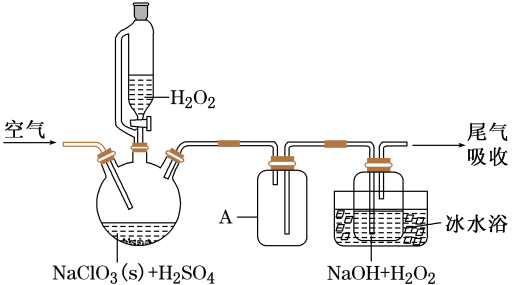
已知:2NaClO3+H2O2+H2SO4=2ClO2 ↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃; H2O2沸点150℃
请回答:
①(用离子方程式表示);
②H2O2+Cl2= 2Cl-+O2+2H+。
I.在锥形瓶中加入足量的碘化钾,用50mL蒸馏水溶解后,再加入3mL稀硫酸;
Ⅱ.再向该锥形瓶中加入20.00 mL自来水;
Ⅲ.用0.0001 mol ·L-1 Na2S2O3溶液滴定测定锥形瓶中生成I2的量。(已知:I2+2=2I-+
),共用去20.00 mL Na2S2O3溶液。
计算可得自来水水样中ClO2的含量为mg/L(精确到0.01)。

检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
a.水 b.酒精 c.油 d.乙酸
该样品中AlCl3的质量分数为(保留3位有效数字)。
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质
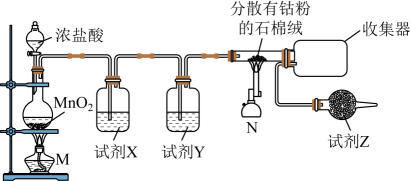
I.制备CoCl2
已知:钴单质与氯气在加热条件下反应可制得纯净CoCl2 , 钴单质在300℃以上易被氧气氧化;CoCl2熔点为86℃,易潮解。制备装置如下:
已知:①Co2+不易被氧化;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3在水中的溶解度曲线如图所示:

③加入少量浓盐酸有利于[Co(NH3)6]Cl3析出。
按图组装好装置→(填序号,下同)→打开磁力搅拌器→控制温度在10℃以下→→加热至60℃左右,恒温20min→在冰水中冷却所得混合物,即有晶体析出(粗产品)。

①缓慢加入H2O2溶液
②滴加稍过量的浓氨水
③向三颈烧瓶中加入活性炭、CoCl2、NH4Cl和适量水

已知:时相关物质的
如下表:
物质 | ||||
回答下列问题:

离子 | |||||
0.601 | 0.15 | 0.3 | 0.001 | 0.1 |
①、稀硫酸、
发生总反应的离子方程式为。
②反应过程中硫酸不能过量太多的原因是。



有关数据如下:
物质 | 苯 | 溴 | 溴苯 |
密度(g· cm-3) | 0.88 | 3.12 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解性 | 不溶 | 微溶 | 不溶 |
回答下列问题:
![]()
制备流程、实验装置及有关数据如下:
![]()
物质 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139. 4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |

①烧瓶内加入乙酸乙酯的作用是,加热回流时间不宜过长,原因是。
②“趁热过滤”的原因是。
③乙酰水杨酸的产率为。


已知:溶液中金属离子开始沉淀和完全沉淀的浓度及溶液的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH c=0.01mol ·L-1 | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时的pH c=1.0× 10-5mol·L-1 | 3.2 | 4.7 | 9.0 | 11.1 |
试回答下列问题:
①Sb3+发生水解反应的离子方程式为。
②下列能促进该水解反应的措施有 ( 填编号)。
A.升高温度 B.增大c(H+)
C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3 , Fe3+的浓度应小于 mol·L-1。
i.在锥形瓶中,将溶于水中,加热至沸,加入研细的
晶体,溶解得到混合溶液;
ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5% 溶液,水浴加热至50~60℃,保持20min;

iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体( ,
)析出;
iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:
实验I:粉红色的溶液在空气中久置,无明显变化。
实验II:向0.1
溶液中滴入2滴酸性
溶液,无明显变化。
实验III:按下图装置进行实验,观察到电压表指针偏转。
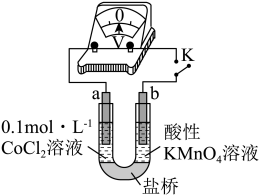
根据实验III得出结论:可以被酸性
溶液氧化。
另一名同学设计了实验IV,否定了该结论,请说明实验IV的操作和现象。

已知:
①TiO2+2C+2Cl2TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
①氮气 ②氧气 ③水蒸气 ④氩气

已知一定条件下,部分金属阳离子形成氢氧化物的pH如下表:
离子 | Co3+ | Fe3+ | Co2+ | Fe2+ | Al3+ |
开始沉淀的pH | 0.3 | 2.7 | 7.2 | 7.6 | 3.6 |
完全沉淀的pH | 1.1 | 3.2 | 9.2 | 9.6 | 5.2 |
请回答下列问题:
A.Na2SO4溶液
B.98%的H2SO4溶液
C.酒精
①H2O2的作用是(填标号)。
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
②H2O2促进了LiCoO2在H2SO4中转化为CoSO4 , 该反应的离子方程式为。
③相同条件下,“酸浸”时钴的浸出率随温度变化如右图所示,此时温度控制在80℃左右的原因为。

A.H2SO4 B.CoCO3 C.石灰乳 D.NaOH