②CH4(g)C(s)+2H2(g) △H2=+74.6kJ•mol-1
③2CO(g)C(s)+CO2(g) △H3=-172.5kJ•mol-1
科研人员研究压强对催化剂活性的影响:在1073K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。

注:Ra是以CH4的转化率表示的催化剂活性保留分率,即反应进行到某一时刻的催化剂活性与反应初始催化剂活性之比。
下列分析错误的是
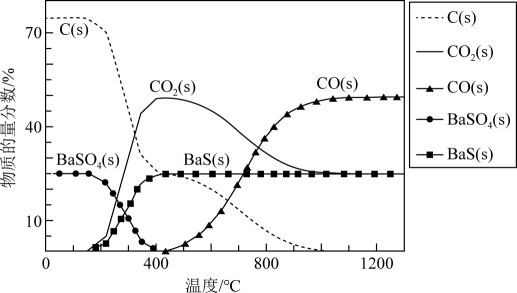
已知:碳热还原BaSO4过程中可能发生下列反应。
i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) △H1
ii.BaSO4(s)+4C(s)=4CO(g)+BaS(s) △H2=+571.2kJ·mol-1
iii.BaSO4(s)+4CO(g)=4CO2(g)+BaS(s) △H3=-118.8kJ·mol-1
下列关于碳热还原BaSO4过程的说法正确的是( )
重整反应 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
积炭反应Ⅰ 2CO(g)=CO2(g)+C(s) ΔH1=―172 kJ·mol-1
积炭反应Ⅱ CH4(g)=C(s)+2H2(g) ΔH2=+75kJ·mol-1
在恒压、起始投料比=1条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是( )


下列有关叙述错误的是( )
反应Ⅰ:
:
反应Ⅱ:
一定压强下,向某容积可变的密闭容器中通入和
的混合气体(其中
和
的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得
的转化率、
的选择性、CO的选择性随反应温度的变化情况如图所示。

已知:或CO的选择性指反应生成
或CO时所消耗的
的物质的量占参与反应的
总物质的量的百分比。
下列说法正确的是( )

下列说法正确的是( )
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H1<0 K1
②2NO(g)+Cl2(g) 2ClNO(g) △H2<0 K2
10分钟时反应达到平衡,测得体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol·L-1·min-1。下列说法正确的是( )
主要副反应:(Ⅱ)H2(g)+CO2(g) CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g) CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )

①
②
其他条件不变时,在相同时间内温度对催化加氢的影响如图。

下列说法错误的是( )
①C(s)+O2(g)=CO2(g) ∆H1 C(s)+O2(g)=CO (g) ∆H2
②S(s)+O2(g)=SO2(g) ∆H3 S(g)+O2(g)=SO2(g) ∆H4
③H2(g)+O2(g)=H2O(l) ∆H5 2H2(g)+O2(g)=2H2O(l) ∆H6
④CaO(s)+H2O(l)=Ca(OH)2(s) ∆H7 CaCO3(s)=CaO(s)+CO2(g) ∆H8

①(V)2NO(g)+O2(g) ![]() 2NO2(g) ∆H1 =-114.0 kJ·mol-1
2NO2(g) ∆H1 =-114.0 kJ·mol-1
②(H)CO(NH2)2(aq) + H2O (l) ![]() 2NH3(g)+CO2(g) ∆H2 = 119.2kJ·mol-1
2NH3(g)+CO2(g) ∆H2 = 119.2kJ·mol-1
③(R)2NH3(g)+NO(g)+NO2(g) = 2N2(g)+3H2O(g) ∆H3=-759.0kJ·mol-1
④(O)4NH3(g)+3O2(g)=2N2(g) + 6H2O(g) ∆H4 =-1530.0 kJ·mol-1
下列说法正确的是( )
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应: ![]() (g)+ I2(g) =
(g)+ I2(g) = ![]() (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度

 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 

该电解池的阳极为,总反应为。电解制备需要在无水条件下进行,原因为。
H2(g)+ O2(g)=H20(1) △H1=-286kJ·mol-1
H2(g)+ O2(g)=H2O2(l) △H2=-188 kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=kJ·mol-1。不同温度下
过氧化氢分解反应的平衡常数K313KK298K (填“大于"“小于”或“等于”)。
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% |
无 | __ | 2 | Fe3+ | 1.O | 15 |
Al3+ | 10 | 2 | Cu2+ | O.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是。贮运过氧化氢时,可选用的容器材质为(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁

①室温下,反应的
(用含
、
或
的代数式表示)。
②基态核外电子排布式为。
③室温下,初始浓度为的
溶液中
随
的变化如图所示。
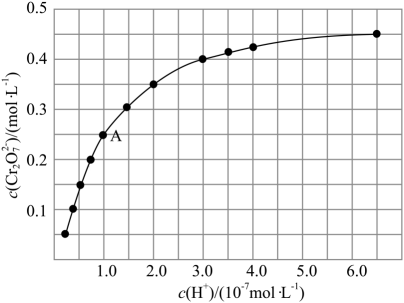
根据A点数据计算反应的
,下列关于该反应的说法不正确的是。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为 , 则
C.若升高温度,溶液中的平衡转化率减小,则该反应的
①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。时,Cr(Ⅵ)的去除率很低的原因是。

②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
得到电子转化为H,。


①该制备过程总反应的化学方程式为。
②电解一段时间后,阳极区溶液中的物质的量由
变成
, 则生成的重铬酸钾的物质的量为
。
①除去原料气中CO的理由是。
②为提高CO吸收率,应选择的条件为。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③中的配体为

①该反应历程中最大活化能对应步骤的化学方程式为。合成氨反应:的
(用图中字母表示)。
②铁催化合成氨时与
需吸附在催化剂表面活性位点进行反应,由合成氨反应的速率方程
(k为速率常数)可知,
越大,反应速率越小。原因是。

决定该过程的总反应速率的基元反应方程式为。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2= kJ·mol-1

a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d. 比值不再发生变化

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是 (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=(MPa)-2(用最简分数表示)。
用氧化烟气中的
时,体系中存在以下反应:
a)
b)
c)
根据盖斯定律,。
d)
e)
不同压强(p)下,的平衡转化率
随反应温度(T)的变化关系如下图所示:

①由图可知,0(填“大于”或“小于”下同),
。
②下列有关该反应体系的说法正确的是(填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大的浓度,反应d、e的正反应速率均增大
③某温度下,平衡时的物质的量分数为
, 且
与
的物质的量分数相等,此时
mol。
光照条件下,催化剂表面产生电子(
)和空穴(
)。电子与
作用生成离子自由基(
),空穴与水电离出的
作用生成羟基自由基(
),
和
分别与
反应生成
。变化过程如下图所示:

一定范围内,NO脱除速率随烟气湿度的增大而增大,结合催化剂的作用机理,分析可能的原因。
ⅰ.;
ⅱ.。
①能说明该反应达到平衡状态的是(填字母)。
A. B.容器内压强一定 C.气体平均相对分子质量一定
D.气体密度一定 E.的体积分数一定
②已知容器的容积为5 L,初始加入和
, 反应平衡后测得
的转化率为50%,则该反应的平衡常数为。
③温度不变,再加入、
、
、
各
, 则
(填“>”“<”或“=”)
。

①该反应的(填“>”或“<”)0。
②图中压强(p)由大到小的顺序是。

①系统工作时,a极为极,b极区的电极反应式为。
②系统工作时b极区有少量固体析出,可能的原因是。
C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是 (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器

①表示v正的直线是 (填“A”或“B")。
②T ℃时,该反应的平衡常数K=。
③T ℃时,向刚性容器中充入一定量NO2 , 平衡后测得c(NO2)为0.1 mol·L-1 , 平衡时NO2的转化率为(保留一位小数)。平衡后v逆=(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2 , NO2的平衡浓度将 (填“增大”“减小”或“不变”)。

2NH3(g) + H2O(1) + SO2(g)=(NH4)2SO3(aq) ΔH=akJ/mol
2NH4HSO3(aq)=((NH4)2SO3 (aq) + H2O(l) + SO2(g) ΔH =bkJ/mol
2(NH4)2SO3(aq) + O2(g)= 2(NH4)2SO4 (aq) ΔH = ckJ/mol
反应2NH3(g) + 2NH4HSO3(aq)+O2(g)= 2(NH4)2SO4+(aq)的 ΔH = kJ/mol(用含a、 b、c的代数式表示)。
①上述条件下H2S的平衡转化事α1= %。
②若在620 K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH 0(填“<” “>”“<或=”)。
③在610 K时反应H2S(g) + CO2(g) COS(g) + H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是 (填标号)。
A.向容器中通入H2S B.向容器中通入CO2
C.加入催化剂 D.缩小容器的体积

①压强: p2 p1(填:“>”或”<”) :判断的理由是。
②若p1=8.1MPa,起始时充入a mol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp= MPa(用平衡分压代替平衡浓度计算,分压-总压×物质的量分数)。
①
H
②
H1=+40.9kJ/mol
③
H2=-90.4kJ/mol
试计算HkJ/mol。

①投料比n(CO2):n(H2)=l:3的曲线是。(填“a”、“b”或“c”)
②已知点N在曲线b上,计算该温度下压强平衡常数Kp=(MPa)-2.(用平衡分压代替平衡浓度计算)
③该温度下,测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=。(保留2位有效数字)

①该反应的活化能Ea=kJ/mol。
②当用更高效催化剂时,请在图中画出Rlnk与关系的曲线。

①温度为T1时,该反应的正反应速率v(B)正v(A)逆(填“>”,“=”或“<”)。
②B、C、D三点逆反应速率由大到小的顺序为。[用“v(D)”、“v(C)”、“v(B)”表示]
①基于铁催化体系(添加了氧化铝和氧化钾)的反应机理及能量变化如图所示,据此计算反应的ΔΗ=。

②中科院大连化学物理研究所科研团队构筑了“过渡金属—LiH”双活性中心催化体系,显著提高了传统金属催化剂在温和条件下的合成氨性能,其反应过程分为以下三步(*表示催化剂的活性位点),据此写出Ⅱ的化学方程式。
I.;Ⅱ.;Ⅲ.
。

①a点对应的转化率:(填“>”“<”或“=”,下同);
。
②c点对应的小于a点对应的
, 解释其原因为。
③a、b、e三点对应的压强平衡常数(、
和
)的大小关系为;a点对应的压强平衡常数
(用体系中各气体的分压来表示,分压=总压×物质的量分数)

①氧化钴中的最外层电子排布式为。
②图中a、b、c三点所对应的平衡常数K的大小顺序为(用字母表示,下同),逆反应速率的大小关系为。
③时,图中a点对应的正反应速率
, 则
。
④时,
的密闭容器中,该反应的
。
Pb催化剂中引入Bi能够提高它的选择性。Bi的价电子排布式为6s26p3 , 其在元素周期表中的位置为。

①写出CO2在酸性介质中电催化还原为HCOOH的电极反应式。
②产物的选择性是由催化剂对两种关键中间体的结合强度决定的。在Pb催化剂表面更利于生成
反应①:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应③:2CO(g) CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
已知25℃时,CH4、CO和H2的燃烧热分别为890 kJ·mol-1、283kJ·mol-1和285.8kJ·mol-1则ΔH1=。

①800℃时CO2的平衡转化率远大于600℃时CO2的平衡转化率,其原因是。
②CH4的还原能力(R)可用于衡量CO2的转化效率,R= (平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=;随温度的升高,R变化趋势为(填“增大”、“减小”、“先减小后增大”)。
I.传统的“哈伯法”反应原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ•mol-1 ΔS=-200J•K-1•mol-1

2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)的ΔH=(用Ea1、Ea2、Ea3、Ea4表示)。已知Ea1<Ea3 , 则两步反应中(填“第一步”或“第二步”)反应决定了生产尿素的反应速率。

①B、C点化学平衡常数K(B)K(C)(填“>”“<”或“=”)。
②在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率v(A)v(B)(填“>”“<”或“=”)。
一种常温常压下NRR反应的装置如图所示,阴极的电极反应式为。

C(s,石墨) +O2(g)=CO2(g) ΔH1= -393.5 kJ·mol-1
H2(g) +O2(g)=H2O(1) ΔH2= -285.8 kJ· mol-1
2C2H2(g) +5O2 (g)= 4CO2(g) +2H2O(1) ΔH3= -2599.0 kJ·mol-1
在298K时由C(s,石墨)和H2(g)反应生成1 mol C2H2(g) 的热化学方程式为。
主反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH1=-156.9kJ· mol-1
副反应:CO2(g) +H2(g) CO(g) + H2O(g) ΔH2= +41.1 kJ·mol -1
工业合成甲烷通常控制温度为500℃左右,其主要原因为。
CH4(g) +4NO(g) 2N2(g) +CO2(g) +2H2O(g) ΔH <0。
当=1时,NO的平衡转化率~
;T2时NO平衡转化率~
的关系如图

①能表示此反应已经达到平衡的是。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C. 不再变化
②表示T2时NO平衡转化率~的关系是(填“I”或“II”),T1T2(填“>”或“<”)。
③在=1、T2时,CH4的平衡分压为 。已知:该反应的标准平衡常数
, 其中
=100 kPa,p(CH4)、p(NO)、p(CO)2、 p(N2)和p( H2O)为各组分的平衡分压,则该温度下
=。(分压=总压 ×物质的量分数。计算结果用分数表示)。

①选择时,温度高于260℃时NO转化率下降的原因为。
②综合分析,该脱硝过程应选择的最佳催化剂中M为。
③选用合适的催化剂还能抑制催化剂表面出现NH4HSO4结晶现象,结晶会导致。
①下列选项不能说明反应I、Ⅱ均达到化学平衡状态的是。
A.混合气体的平均摩尔质量保持不变 B.n(NH3)∶n(NO)保持不变
C.有1molN-H键断裂的同时,有键断裂 D.NO的分压保持不变
②达到平衡后测定O2转化率为30%,体系中NH3为1.2mol。则NO的转化率为,反应I的Kp=(写出计算式即可)(分压=总压×物质的量分数)。
①CO(g)+2H2(g)CH3OH(l) ΔH1=-116kJ/mol
②CO(g)+3H2(g)CH4(g)+H2O(l) ΔH2=-206kJ/mol
③2CH3OH(l)C2H4(g)+2H2O(l) ΔH3=-35kJ/mol
计算④2CO(g)+4H2(g)C2H4(g)+2H2O(l)的ΔH=


该条件下生成乙烯最适宜的温度是。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当。
②2CH3OH(g)+ 3O2(g) =2CO2(g)+4H2O(g) ΔH =−1353 kJ∙mol−1
则CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) ΔH = kJ∙mol−1。
T/℃ | 170 | 180 | 1 90 | 200 | 210 | 220 | 230 |
STY/[mol/(mol·h)] | 0.10 | 0.15 | 0.20 | 0.25 | 0.28 | 0.20 | 0.15 |
①该反应最适宜的温度是。
②在220℃和170 ℃条件下,该反应速率之比: υ(220℃): υ(170℃)=。
③随温度升高,甲醇的时空收率先增大后减小,可能的原因是。

①分析温度高于236℃时图中曲线下降的原因。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244℃时反应生成CH3OH的物质的量为mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp=。 ( 列出计算式即可)
①尿素的合成分两步进行:
a.
b.
则总反应的ΔH=。
②如图为时,温度对
的转化率的影响。解释温度升高
的平衡转化率增大的原因:

①甲醇还可以与乙酸反应制香料,反应方程式为 , 制香料反应的平衡常数K的表达式为。
②850℃时,反应的平衡常数K=160,在密闭容器中进行该反应,开始时只加入
、
, 反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
物质 | ||||
浓度/( | 0.2 | 0.2 | 0.4 | 0.4 |

①从反应开始至达到化学平衡时,以表示的平均化学反应速率为
。
②若该反应的正、逆反应速率分别可表示为 ,
,
、
分别为正、逆反应速率常数, A、B两点对应的时刻,该反应的正反应速率之比
。
③若平衡时总压强为pkPa,用平衡分压代替其平衡浓度表示的化学平衡常数 [已知:气体分压(
)=气体总压(
)×该气体的体积分数]。
甲醇和水蒸气制取氢气的过程中有下列反应:
kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式。
硼氢化钠()是研究最广泛的储氢材料之一
已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下在水中的溶解度为55 g,
在水中的溶解度为0.28 g
在配制溶液时,为了防止发生水解反应,可以加入少量的(填写化学式)。


①钛电极的电极反应式是。
②电解过程中,阴极区溶液pH(填“增大”“减小”或“不变”)
已知:
kJ·mol
kJ·mol
kJ·mol
的
。

①已知 , 比较
和
酸性强弱并从结构的角度说明理由:。
②写出工业废水时,
氧化
生成
和
的离子方程式:。
③一种采用电化学方法制取的装置原理如图所示。阳极使用的是易被氧化的活性铁电极。电解池阳极室中KOH溶液的浓度为14 mol·L
、电解60 min,调节不同的电压,测得反应后溶液中
的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图所示。

I 写出制取的电极反应式:。
II 电流密度大于4 mA·cm时,所得反应后溶液中
的浓度上升幅度变小的原因是。
方法I:CH4(g)+O2(g)
CH3OH(g) △H1=-126.4kJ•mol-1
方法II:CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1 , 则△H2=。

①下列措施可以提高CH4的平衡转化率的是(填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为(精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数=(列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)
gG(g)+hH(g),
=
, 其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是。

已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因:。

写出ZrO2/NiCo2O4电极的反应式:。
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH2=-2044kJ•mol-1
对于不同配比的燃料,定义过量空气系数为完全燃烧1kg燃料所实际供给的空气质量与所需的理论空气质量的比值。
请回答下列问题:
物质 | NH3(g) | H2O(g) |
ΔH(kJ•mol-1) | -46 | -242 |
则ΔH1=kJ•mol-1
I.4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH3<0,K1=8.5×1023(2065K)
II.4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH4<0,K2=7.0×1046(2065K)
III.N2(g)+O2(g)=2NO(g) ΔH5>0,ΔS>0
①反应III能自发进行的条件是。
②α分别为0.9、1.0、1.1时,烟气中CO排放浓度随氨体积分数变化的关系如图甲所示。α=0.9对应的曲线是(填“X”“Y”或“Z”),理由是。
③烟气中NO排放浓度随着氨的体积分数变化的关系如图乙所示。氨的体积分数大于10%时,NO排放浓度逐渐减低的原因为。

④丙烷中掺氨燃烧的优点是。