
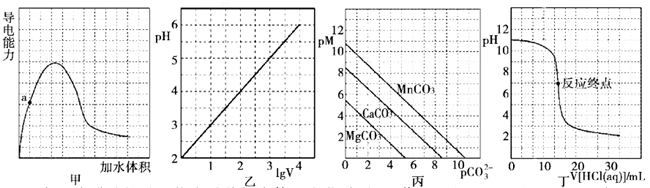
下列叙述正确的是( )











|
编号 |
平衡方程式 |
平衡常数 |
|
① |
HCN |
Ka= 1×10 -10 |
|
② |
H2O |
Kw=1×10 -14 |
|
③ |
CN-+H2O |
K =? |
则下列判断错误的是( )


准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。(写出计算过程, )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值(填“偏高”或“偏低”)。

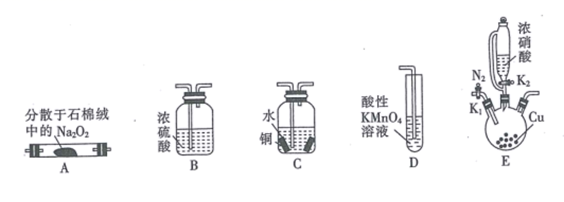
①通入氮气的目的是。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是。
④样品完全分解后,装置A中的残留物含有 和
,检验
存在的方法是:。
①称量 样品于锥形瓶中,溶解后加稀
酸化,用
溶液滴定至终点。滴定终点的现象是。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
溶液滴定至终点,消耗
溶液
,该晶体中铁的质量分数的表达式为。
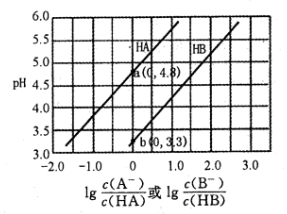
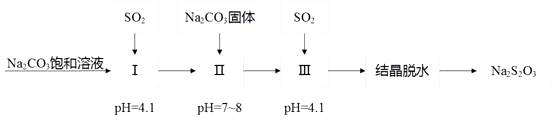 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。
②工艺中加入Na2CO3 , 固体,并再次充入SO2的目的是。
![]()
i.向V2O5中加入足量盐酸酸化的N2H4·2HCl溶液,微沸数分钟。
ii.向制得的VOCl2溶液中缓慢加入足量NH4HCO3溶液,有气泡产生并析出紫红色晶体。
iii.反应结束后抽滤,用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,静置一段时间后得到产品。
请回答下列问题:

①仪器M的名称是。
②装置B的作用是。

已知:①2NO+Na2O2 =2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO ;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3 +2NO↑+ H2O。
回答下列问题:
已知:①2NO +4H++2I- =2NO↑ +I2 +2H2O
②I2+2Na2S2O3=2NaI+Na2S4O6
|
甘氨酸(H2NCH2COOH) |
柠檬酸 |
甘氨酸亚铁 |
|
易溶于水,微溶于乙醇,两性化合物 |
易溶于水和乙醇,有酸性和还原性 |
易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中缓慢加入200mL1.1mol•L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
②A中反应产生的气体是,C中空气排净时,D中现象是。
③洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是(填标号)。
a.乙醇 b.热水 c.柠檬酸溶液
①称量6.0g甘氨酸亚铁样品,将其全部溶于稀H2SO4中,配制成250mL溶液。取10.00mL配制好的溶液于锥形瓶中,用0.10mol•L-1的Ce(SO4)2溶液滴定,以邻二氮菲为指示剂。当溶液由红色变为浅蓝色且半分钟之内不恢复原色,滴定达到终点。若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填“偏高”“偏低”或“不变”)
②滴定时消耗9.60mLCe(SO4)2溶液,则甘氨酸亚铁样品中Fe2+的氧化率为。
已知:金属离子浓度为 时生成氢氧化物沉淀的
| | | | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是。
②上述滴定过程中操作滴定管的图示,正确的是。

③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH 溶液浓度(填“偏大”、“偏小”或“无影响”)。
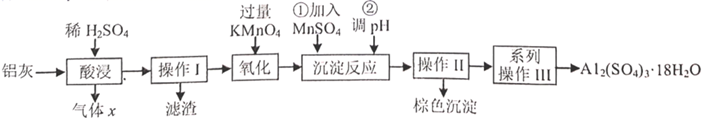
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是(填字母序号)。
②判断滴定终点的依据是。
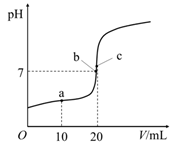
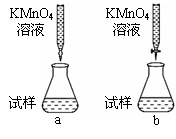
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是____(填选项字母)。
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| KSP | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2 , 冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L−1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F−与Fe3+生成稳定的FeF63−(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I− ⇌ I3−(棕黄色)。
ⅳ.I2+2Na2S2O3= 2NaI+Na2S4O6(无色)。
①加入NH4F溶液的目的是。
②Cu2+和I−反应的离子方程式是。
③加入过量KI溶液的作用是。